UTILISATION DU MICROSCOPE | dernière modification le 09/13/2024 |
Réglage d'un microscope traditionnel, d'un microscope à contraste de phase ou d'un microscope à fluorescence.
Le microscope est l'élément clef du laboratoire, celui grâce à qui nous pouvons réaliser 80% des analyses médicales. Il doit être de bonne qualité, l'argent investi dans un bon microscope n'est pas de l'argent perdu, un microscope de qualité bien entretenu et bien stocké peut être opérationnel pendant 30 ans. Préférer un microscope mixte électrique et solaire, si possible binoculaire. Il doit impérativement être accompagné des objectifs 4, 10, 40 et 100 à immersion.
Description du microscope :
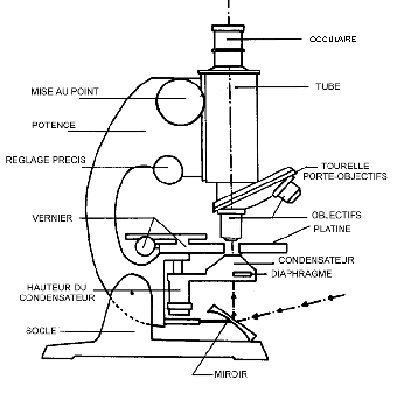
Utilisation du microscope :
- Commencer toujours par regarder la préparation à faible grossissement pour repérer les zones intéressantes.
- Utiliser l'objectif 25 pour affiner un diagnostic.
- Utiliser l'objectif à immersion pour les recherches de paludisme, les formules leucocytaires, les détails de kystes de protozoaires.
Entretien du microscope :
- Maintenir le microscope couvert d'une housse propre en tissu ou en matière plastique en dehors des périodes d'utilisation.
- Veiller plus particulièrement à protéger le microscope de la poussière en saison chaude et sèche.
- Veiller plus spécialement à protéger les lentilles et les prismes du microscope contre le développement des moisissures en saison chaude et humide.
- Conserver le microscope dans une boite spéciale, débarrassée de son humidité, éventuellement grâce à des cristaux de potasse (achetés ou récupérés dans les boites de MEG : sachets ou capsules). Attention à la toxicité du produit.
- Dans les régions ou il n'y a pas l'électricité, installer une étagère destinée à recevoir la boîte du microscope à environ 30cm au-dessus de la bouche d'évacuation du réfrigérateur ou du congélateur à gaz ou a pétrole: on peut ainsi la maintenir suffisamment au sec pour protéger les lentilles contre les moisissures.
- Nettoyer tous les jours l'objectif à immersion pour enlever l'huile à immersion: utiliser un chiffon doux et polir avec un chiffon propre ne peluchant pas.
- Nettoyer les oculaires avec un chiffon doux non pelucheux ou du papier d'essuyage optique.
- En cas d'apparition de moisissures dans les optiques, on peut essayer de les laver avec un chiffon non pelucheux imbibé de salive, ce qui peut les faire disparaître.
- Rappeler le numéro de référence du modèle et si possible celui de l'instrument et de la pièce lors des commandes de pièces détachées
Ce qu'il ne faut pas faire :
- Ne pas employer le papier ou le chiffon utilisé pour l'objectif à immersion pour nettoyer les oculaires.
- Contaminer les objectifs sans immersion avec de l'huile : elle pénétrerait dans l'objectif qui deviendrait vite inutilisable.
- Ne pas employer d'alcool pour nettoyer les surfaces peintes du microscope.
- Ne pas laisser vides les supports destinés à recevoir les lentilles; boucher l'ouverture avec le capuchon prévu à cet effet ou à défaut avec du sparadrap.
- Ne pas intervertir les lentilles appartenant à des microscopes de fabrication différente, il arrive même que des modèles produits par un même fabricant aient des caractéristiques différentes.
Annexe : Microscopes utilisés à Sindou
REGLAGE D’UN MICROSCOPE
Deux types de microscopes :
1- Microscope traditionnel, ou réel
L’objectif projette une image réelle intermédiaire dans le tube. L’oculaire fonctionne comme une loupe qui va créer une image réelle par le système oculaire / cristallin / rétine. Il y a toutefois des contraintes à ce type de microscope. Si on insère un élément dans le trajet optique, on va modifier ce trajet donc la place de l'image donnée par l'objectif (par exemple en cas de microscopie à fluorescence, on interpose les systèmes de filtres et de miroir).
Le réticule est un petit réseau qui, sur certains modèles, peut être inséré à l’endroit de formation de l’image réelle. Ce petit réseau sert à régler la mise au point, ensuite on pourra voir l’image réelle se former au niveau du réseau. Ceci est essentiellement utilisé en microphotographie. Les optiques des systèmes réels sont de plus en plus difficiles à trouver.
2- Microscope « à l’infini »
Ce sont les microscopes modernes actuels. L’objectif projette une image réelle à l’infini (faisceaux parallèles). L’oculaire est une simple lentille de Galilée.
L’image se forme à l’infini, il n’y a donc plus de variation de la place de l’objet si on intercale des compléments optiques dans le trajet des rayons.
On parle de grandissement lors d’une image réelle et de grossissement lors d’une image virtuelle (par exemple une loupe).
REGLAGE DU MICROSCOPE TRADITIONNEL
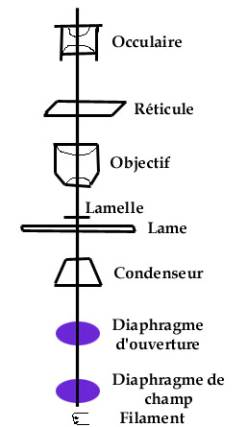
Note : seuls les microscopes évolués peuvent être réglés complètement Buts du réglage : 1. Utiliser toute la lumière nécessaire (pour avoir une image la plus lumineuse possible) mais seulement la lumière nécessaire (sinon on perd du contraste), c’est à dire diminuer la réflexion de la lumière dans le tube 2. Aligner les centres optiques des lentilles Ci-contre, on trouve le schéma du circuit lumineux dans un microscope traditionnel De bas en haut, on trouve le filament, puis les diaphragme de champ (souvent localisé sur le statif) et d’ouverture (souvent localisé sous la platine), le condenseur d’Abbe (qui rend les faisceaux parallèles), la lame (une lentille de zéro dioptrie) et la lamelle. On trouve ensuite l’objectif, composé de 2 lentilles au minimum : une frontale et une de « champ arrière ». Dans certains microscopes traditionnels ou « réels », on trouve le réticule (pas dans les microscopes « à l’infini). En dernier vient l’oculaire, composé de 1 ou 2 lentilles. |
Ceci ne comprend pas le ou les renvois ou miroirs (oculaires inclinés à environ 45°) qui peuvent se trouver dans un microscope.
Note : les diaphragmes ne sont pas faits pour limiter la quantité de lumière. Pour ceci, on dispose d’un potentiomètre ou de filtres.
Ne pas oublier qu'avant tout réglage, il faut nettoyer soigneusement tous les éléments optiques accessibles. L'eau et la savon sont des moyens sans risque pour le matériel et efficace si appliqués soigneusement. On utilise pour frotter des papiers spéciaux pour optique (non abrasifs) ou des chiffons de coton lavés de nombreuses fois pour ne plus pelucher.
En théorie :
1. L’image du diaphragme de champ doit se projeter au niveau de l’objet. On joue donc sur la hauteur du condenseur. On utilise souvent une butée haute réglable, le plaçant correctement.
2. L’image du diaphragme d’ouverture doit se projeter au niveau du champ arrière de l’objectif. On retire l’oculaire, on le remplace par un oculaire de mise au point (ou à défaut à l’œil) pour effectuer le réglage.
3. L’image réelle de l’objet doit se trouver sur le plan du réticule. On règle la distance entre les deux oculaires (qui modifie la distance optique), puis une éventuelle amétropie sur un œil.
En pratique :
1. Ouvrir au maximum les deux diaphragmes
2. Déposer une trace de feutre ou de pointe diamant sur une lame
3. Choisir l’objectif qui sera optimisé pour le réglage (généralement X20 ou X 40), en effet, au bout d’un moment d’utilisation, la tourelle n’est plus identique pour tous les objectifs, on optimise donc le réglage pour l’un d’entre eux.
4. Fermer le diaphragme de champ. On doit ensuite mettre au point l’image du diaphragme puis centrer le condensateur :
- mise au point de l’image : réglage du condensateur en hauteur
- centrage du condensateur grâce aux deux petites vis, allant en contre poussée sur un ressort.
On appelle cela le réglage de Kohler. On a une image au point et qui occupe tout le champ.
5. Enlever un des oculaires, placer l’oculaire accessoire (ou à défaut à l’œil)
6. Fermer le diaphragme d’ouverture, le rouvrir progressivement. On observe une image qui grossit. Lorsqu’elle arrête de grandir, on s’arrête. En fait, le diaphragme est généralement ouvert entre 1/5 et ¼ de son ouverture complète.
7. Remettre l’oculaire. Le microscope est réglé.
Si on passe à un grossissement plus fort (X 100 immersion), l’ouverture de l’objectif est plus petite, et pourtant, on ferme un peu le diaphragme ! En fait, le champ observé est plus petit et, pour obtenir un meilleur contraste (moins de réflexions parasites), on ferme le diaphragme.
REGLAGE DU MICROSCOPE A CONTRASTE DE PHASE
Dans ces microscopes, on remplace le diaphragme d’ouverture par une lame de verre noir sur lequel est gravé un cercle transparent donc lumineux (schéma, à droite).
On utilise des objectifs spéciaux, notés Ph (pour phase) sur le côté. Sur le plan arrière de l’objectif se trouve un anneau (schéma, à gauche, vue en coupe) dont l'épaisseur correspond à ¼ de la longueur d’onde de la raie jaune du sodium . La phase est donc décalée.
Réglage du microscope :
Le but est de projeter l’image du cercle sur l’anneau. Tout d’abord, l’association entre l’anneau de phase et l’objectif doit être cohérente : les objectifs sont notés Ph 1, 2 ou 3. De même, la tourelle située sous le condenseur doit être placée sur le même numéro (choix de la lame produisant l’anneau lumineux). |
Ensuite, on aligne les systèmes en calant l’image de l’anneau sur l'image du plan arrière de l’objectif en agissant sur le réglage propre de l'anneau de phase (même type de réglage que pour le réglage de la position horizontale du condensateur : 2 vis et une contre poussée).
REGLAGE DU MICROSCOPE A FLUORESCENCE
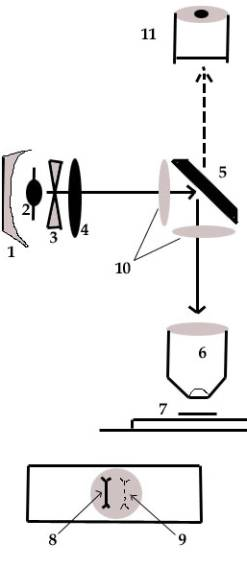
Les microscopes à fluorescence peuvent être dangereux pour les yeux (risque de conjonctivite des neiges), spécialement si le système d’éclairage est direct (même trajet optique que la lumière de l'éclairage classique).
Actuellement on n'utilise plus que les systèmes épiscopiques où le faisceau d'UV incident passe par l'objectif d'observation (il joue, pour les UV, le rôle de condenseur). Légende : 1. miroir réglable par 3 vis (cf condenseur) 2. source lumineuse (arc électrique) 3. diaphragme optionnel 4. lentille L 5. miroir de renvoi 6. objectif, il joue aussi le rôle de condenseur (l’intensité lumineuse est donc très forte) 7. lame et lamelle 8. arc très brillant (vient de l’arc lui même) 9. image réelle de l’arc (provient du miroir) 10. filtres 11. oculaire d’observation |
But du réglage :
La lumière doit éclairer tout le champ arrière de l’objectif, mais pas plus. Le problème vient de l’étroitesse de l’arc électrique, ce qui peut conduire à n’observer la fluorescence éventuelle que sur la moitié du champ. On procède donc à différents réglages :
1. sens de la lampe dans son support (attention à la soudure ou à une éventuelle zone argentée)
2. réglage du miroir concave et de l'arc. Cette opération peut être longue, attention à ne pas le dérégler par la suite
Réglage proprement dit :
1. Utiliser une zone de la tourelle sans objectif, ou retirer un objectif
2. Placer une carte de visite (ou un carton blanc) à la place de la lame
3. Régler la lentille L de manière à voir l’image de l’arc sur la carte (8 sur la figure)
4. Régler très doucement le miroir (risque de perte de l’image si trop brutal) afin d’obtenir deux images côte à côte de l’arc (9 sur la figure). On obtient ainsi un éclairage homogène de tout le champ.
5. On peut aussi utiliser le diaphragme optionnel
6. Remettre l’objectif, placer une lame pour fluorescence (fond rouge avec des puits transparents). Faire la mise au point sur le rouge : la fluorescence doit être bien homogène et couvrir tout le champ.
Les préparations doivent être regardées rapidement : il y a une diminution très significative de la fluorescence avec le temps. Attention aux tampons spontanément fluorescents (tampons glycérinés standard entre autre). Attention aussi à l’huile à immersion spontanément fluorescente.
Généralement, on adapte son microscope à fluorescence au travail que l’on va y effectuer grâce à un système de filtres (n° 10 sur le schéma).
Ces filtres sont des systèmes comprenant dans l’ordre :
- un limiteur de longueur d’onde d’excitation
- un miroir réfléchissant totalement les UV, et totalement perméable à la lumière visible
- un filtre de réduction du rayonnement UV, qui laisse passer la fluorescence (pour pouvoir l’observer)
Ce système limiteur / filtre fonctionne en couple, optimisé pour un fluorochrome. Le système le plus utilisé s’appelle ITCF pour isothiocyanate de fluoresceïne. Ce système est valable pour l' isothiocyanate de fluoresceïne, l’auramine, l’acridine orange et la rhodamine.
